Migraña
Actualización sobre patogenia, tratamiento y prevención de la migraña aguda.
La migraña es un trastorno neurológico ubicuo que se estima afecta a aproximadamente mil millones de personas en todo el mundo, predominantemente mujeres.1 Según el Estudio de Carga Mundial de Enfermedades del 2016, la migraña es la segunda causa principal de discapacidad y representa más discapacidad que todos los otros trastornos neurológicos combinados.2
El diagnóstico se basa en criterios clínicos proporcionados por la Clasificación Internacional de Trastornos de Cefalea, 3a edición (International Classification of Headache Disorders, 3rd edition, ICHD-3).3
Las características clínicas generales que sugieren migraña son los ataques recurrentes de cefalea con dolor de intensidad moderada a severa, con una duración de 4 a 72 horas.3 Se debe considerar el diagnóstico de migraña si un ataque típico de cefalea es unilateral, pulsátil y agravado por la actividad física.3
Algunas personas informan que la migraña está precedida por un aura, que se caracteriza por síntomas neurológicos focales reversibles, que generalmente comprenden alteraciones visuales o hemisensoriales.3
Aunque la patogenia de la migraña no se comprende completamente, se considera que involucra al nervio trigémino y sus proyecciones axonales a la vasculatura intracraneal (denominado sistema trigémino-vascular).4 Las señales nociceptivas del sistema trigémino-vascular se transmiten a áreas en el cerebro que producen la percepción del dolor de la migraña.4
Se ha avanzado más en la comprensión de la patogenia con la identificación de moléculas de señalización que están involucradas en la génesis del ataque de migraña. Este avance ha facilitado el desarrollo de terapias basadas en mecanismos para la migraña.5
Esta revisión describe la comprensión actual de la patogenia de la migraña, que se basa predominantemente en datos clínicos publicados en los últimos 10 años, y describe las prácticas recomendadas para el tratamiento de la migraña aguda y para el tratamiento preventivo de la migraña, destacando los medicamentos que han sido aprobados recientemente.
Epidemiología de la migraña
La migraña es el segundo trastorno neurológico más prevalente (después de la cefalea de tipo tensional), con una proporción de mujeres a hombres de 3:1 y una prevalencia anual estimada de aproximadamente el 15% en la población general.1
La prevalencia alcanza su punto máximo entre las edades de 35 y 39 años, y alrededor del 75% de las personas afectadas informan la aparición de migraña antes de los 35 años.1,6
La migraña también afecta a una proporción considerable de niños, con un estudio basado en población que muestra una prevalencia anual de alrededor del 7% entre los niños en edad escolar.7
Diagnóstico de la migraña
La ICHD-3 proporciona criterios diagnósticos para las tres categorías principales de migraña: migraña sin aura, migraña con aura y migraña crónica (Tabla 1).3 La migraña con aura generalmente implica centelleos visuales y escotomas y, con menos frecuencia, propagación de síntomas hemisensoriales o disfunción del habla; estos síntomas neurológicos focales reversibles se desarrollan gradualmente durante un período de 5 a 60 minutos.3
El diagnóstico debe incluir un examen físico, aunque generalmente no hay hallazgos anormales. El diagnóstico diferencial de la migraña incluye otros trastornos primarios de cefalea, principalmente cefalea de tipo tensional y algunos trastornos de cefalea secundarios, como el dolor de cabeza postraumático.3
Las características sugestivas de un trastorno de cefalea secundario incluyen traumatismo craneoencefálico reciente, cefalea que empeora progresivamente y cefalea en trueno (inicio repentino de un dolor de cabeza extremadamente severo). Los signos de alarma al examen físico que requieren considerar diagnósticos distintos de la migraña son fiebre, rigidez del cuello y pérdida de peso.8
Características genéticas
Es común tener antecedentes familiares de migraña, con una heredabilidad estimada en aproximadamente 42%.9 En un meta-análisis de asociación de genoma completo, se identificaron 38 loci de susceptibilidad para la migraña, y se enriquecieron las variantes de riesgo en genes relacionados con el músculo liso vascular y visceral.10
Estos hallazgos son intrigantes porque la participación vascular en la patogenia de la migraña ha sido debatida a lo largo de los años.11 En otro análisis, los hallazgos también sugirieron el enriquecimiento neuronal de marcadores genéticos.12
En resumen, los estudios genéticos han demostrado que el riesgo de migraña es poligénico, con raras excepciones de síndromes monogénicos relacionados con la migraña como la migraña hemipléjica familiar.
Patogénesis
En 1984, Moskowitz propuso que el inicio de la migraña depende de la activación y sensibilización de neuronas trigémino-vasculares de primer orden.
Las fibras aferentes de estas neuronas inervan las meninges y sus vasos y también se proyectan a estructuras en el sistema nervioso central.21 La activación de estas neuronas libera péptidos vasoactivos e induce reacciones inflamatorias locales.21
Este proceso, a su vez, sensibiliza y descarga neuronas de segundo orden en el tronco encefálico y luego neuronas de tercer orden en el tálamo,4 hasta que finalmente los impulsos nociceptivos alcanzan el área somatosensorial y otras áreas corticales que están involucradas en la percepción del dolor.4
Los mecanismos que inician un ataque de migraña no están claros. Alguna evidencia favorece un origen periférico a nivel de las vías aferentes trigeminales perivasculares,4,11 mientras que otros datos sugieren que la génesis es más probable dentro del sistema nervioso central, implicando la disfunción de neuronas en el tronco encefálico y el diencéfalo.4,11
Un rasgo inherente de la migraña es su naturaleza recurrente. Los pacientes a menudo describen factores que perciben como desencadenantes de sus ataques de migraña (ej., estrés, trastornos del sueño, determinados alimentos, ayuno).22 Sin embargo, las evaluaciones retrospectivas se ven limitadas por el sesgo de recuerdo y la falsa atribución.23
La alta frecuencia de atribución errónea a los desencadenantes está respaldada por un estudio destinado a inducir ataques de migraña mediante la exposición de pacientes con antecedentes de migraña con aura a los desencadenantes autopercibidos.24
Solo 3 de 27 pacientes tuvieron ataques de migraña después de la exposición a su desencadenante personal, sugiriendo, contrario a la creencia popular, que el papel de estos desencadenantes es limitado.
Modelos clínicos de la migraña
Las moléculas de señalización implicadas en la génesis de un ataque de migraña se han identificado en modelos clínicos.5 Estas moléculas, que son potentes vasodilatadores y están ampliamente distribuidas en el sistema trigémino-vascular, incluyen el péptido relacionado con el gen de la calcitonina (PRGC), el péptido activador de adenilato ciclasa pituitaria 38 (PAACP-38), y el óxido nítrico.5 Para determinar si estas y otras moléculas tienen un papel en la patogenia de la migraña, el autor y sus colegas se las administraron a pacientes con migraña y a voluntarios sanos.5
Tres décadas de estudios utilizando este modelo han establecido que los ataques de migraña se desarrollan en pacientes con migraña cuando están expuestos a estas moléculas, mientras que las personas sanas informan una cefalea leve o nada. Por ejemplo, la infusión intravenosa de trinitrato de glicerilo (TNG) donante de óxido nítrico indujo ataques en el 80% de los pacientes con migraña, la infusión de PRGC en el 57% y la infusión de PAACP-38 en el 58%.13-15
Además, los fármacos que bloquean la degradación del guanosín monofosfato cíclico (GMPc) y del adenosin monofosfato cíclico (AMPc) indujeron ataques de migraña en más del 80% de los pacientes con migraña.16,17
La observación de que el TNG causa un aumento del GMPc intracelular y que el PRGC y el PAACP-38 causan un aumento del AMPc5 intracelular ha llevado a la especulación de que estos son mecanismos neuroquímicos unificadores que incitan a la migraña. Hay evidencia preclínica de que la activación de las vías mediadas por AMPc y GMPc resulta en la apertura de canales de potasio sensibles al ATP (KATP).18,19
Estos hallazgos han llevado a la hipótesis de que la modulación de la transmisión nociceptiva por los canales iónicos, principalmente los canales de potasio, puede ser una vía final común en la génesis de un ataque de migraña.20 Esta hipótesis ha sido apoyada por la observación de que los ataques se desarrollaron en todos los pacientes con migraña después de una infusión intravenosa del abridor de canales KATP levcromakalim.20
Explicar los hallazgos de los modelos clínicos de migraña en el marco del sistema trigémino-vascular ha sido un desafío.21 Es posible que durante un ataque de migraña, los canales KATP se abran en las células del músculo liso vascular de las paredes de las arterias intracraneales,25 provocando vasodilatación.26,27
Esto, a su vez, activa los aferentes primarios trigeminales perivasculares, generando impulsos nociceptivos que se transmiten a regiones cerebrales corticales y subcorticales a través de vías del dolor trigeminales ascendentes y finalmente resulta en la percepción del dolor de la migraña.4
Esta línea de razonamiento enfatiza que las elevaciones de los niveles extracelulares de iones cargados positivamente, tal vez no exclusivamente potasio, pueden activar y sensibilizar los aferentes primarios trigeminales perivasculares. La actividad moduladora de los canales iónicos ha sido descripta en otros trastornos de dolor paroxístico, como el síndrome de dolor episódico familiar.28,29
Perspectivas de modelos clínicos de migraña y datos pre clínicos de apoyo también han proporcionado una base para el desarrollo de terapias dirigidas. No todas han resultado eficaces para el tratamiento de la migraña, y algunas solo proporcionan beneficios terapéuticos modestos, hallazgos que subrayan los complejos fundamentos biológicos del trastorno.
Por ejemplo, la evidencia inicial de un pequeño ensayo clínico aleatorizado mostró que apuntar a la señalización del óxido nítrico a través de la inhibición no selectiva de la óxido nítrico sintetasa (ONS) fue prometedor como tratamiento para la migraña.30
Sin embargo, la inhibición selectiva de la ONS inducible (una de las tres isoformas) no fue beneficiosa en ensayos más amplios.31,32 Se desconoce si otras isoformas de ONS (ONS endotelial y neuronal) podrían ser eficaces para el tratamiento inicial o preventivo.
Los modelos clínicos de migraña también han generado el desarrollo de fármacos dirigidos al PRGC o su receptor.4 Tres pequeños antagonistas del receptor han resultado beneficiosos para el tratamiento inicial de la migraña y cuatro anticuerpos monoclonales dirigidos contra el PRGC o su receptor han demostrado ser eficaces para la prevención de la misma.
Estas drogas y su integración en el manejo clínico de la migraña se describen a continuación. También se han desarrollado fármacos dirigidos al PAACP-38 o al receptor del polipéptido activador de adenilato ciclasa tipo I (PAC1) hipofisario para la prevención de la migraña.33,34
Un anticuerpo monoclonal del receptor PAC1 fracasó en un estudio de prueba de concepto,33 mientras que otro anticuerpo monoclonal, diseñado para apuntar al PAACP, se encuentra en una etapa temprana de desarrollo.34
Fase de aura de la migraña
Se cree que la base fisiológica de la fase de aura de la migraña es una depresión de propagación cortical, una ola de despolarización auto-propagada a través de la corteza cerebral que interrumpe gradientes iónicos y es seguida por hipoperfusión cerebral.35
Se han documentado cambios hemodinámicos que acompañan a la depresión de propagación cortical en neuroimágenes de pacientes con migraña con aura, mientras que no se han encontrado cambios en pacientes con migraña sin aura.36
Una pregunta fundamental sobre la patogenia de la migraña se refiere a los mecanismos subyacentes de activación del sistema trigémino-vascular a través de la propagación de la depresión cortical, que conduce a la fase de cefalea de la migraña con aura.4,35 En una posible cascada de eventos, la propagación de la depresión abre transitoriamente los canales de pannexina-1 neuronales,37 lo que resulta en la liberación de mediadores inflamatorios (por ejemplo, óxido nítrico y prostanoides) que son dilatadores de las arterias intracraneales.5
Se supone que estos procesos activan y sensibilizan a las vías aferentes primarias del trigémino que terminan en el espacio perivascular de las arterias intracraneales.38 De esta manera, la propagación de la depresión activa y sensibiliza las vías aferentes primarias trigeminales perivasculares que son responsables de la transmisión de impulsos nociceptivos, que se procesan posteriormente en áreas corticales, dando la percepción del dolor de migraña.
Tratamiento
El tratamiento clínico de la migraña debería idealmente ser iniciado y mantenido por médicos de atención primaria, con derivación al especialista ante casos difíciles de diagnosticar o que no responden al tratamiento.8 La terapia farmacológica, el pilar del tratamiento, incluye medicamentos iniciales y preventivos, con terapias no farmacológicas utilizadas como complementos de la medicación.8
Las terapias no farmacológicas pueden utilizarse como tratamiento preventivo independiente en el caso de pacientes en los que es mejor evitar el uso de medicamentos, por ejemplo, mujeres embarazadas.8,39
Existe evidencia modesta del beneficio de los dispositivos neuromoduladores no invasivos, las terapias bioconductuales y la acupuntura,40-42 mientras que hay poca o ninguna evidencia en apoyo de la fisioterapia, la manipulación quiropráctica o los enfoques dietéticos para el tratamiento de la migraña en adultos.43-45
Tratamiento temprano
Como principio general, los medicamentos utilizados en la práctica clínica para aliviar o eliminar el dolor de la migraña deben administrarse temprano en la fase de cefalea de un ataque (es decir, cuando el dolor de cabeza todavía es leve).8 Los medicamentos iniciales más utilizados para la migraña son los antiinflamatorios no esteroides (AINE),45 que son analgésicos de venta libre y de bajo costo.
La eficacia ha sido mejor documentada para el ácido acetilsalicílico, el ibuprofeno y el diclofenac.46-48 Los triptanos se consideran medicamentos de segunda línea, y en pacientes para quienes un triptano oral es ineficaz, otros de la misma clase de droga pueden proporcionar un alivio adecuado del dolor.55
A la fecha, siete triptanos orales (almotriptán, eletriptán, frovatriptán, naratriptán, rizatriptán, sumatriptán, y zolmitriptán) están disponibles para uso clínico. Se aconseja a los pacientes que cambien de un triptano a otro si se han producido tres ataques de migraña tratados sin éxito.8 Si el tratamiento con un triptano oral proporciona algo de alivio del dolor pero inadecuado, los médicos pueden recomendar la combinación de un triptano oral con un AINE de acción rápida (por ejemplo, sumatriptán y naproxeno sódico).49
El sumatriptán subcutáneo es el método de dosificación más eficaz en base a la proporción de pacientes que informan estar libres de dolor 2 horas después del tratamiento, pero su uso es limitado porque cuesta más y se consigue mucho menos que los triptanos orales. Por lo tanto, el sumatriptán subcutáneo se ofrece por primera vez cuando un paciente ha tenido un alivio inadecuado del dolor con los triptanos orales.50
Se puede hacer una excepción para los pacientes que no pueden ingerir triptanos orales por vómitos o una cefalea que se exacerba rápidamente. Los médicos deben ser conscientes del riesgo de cefalea por abuso de medicamentos, que es la condición de dolor de cabeza o aumento de la frecuencia del dolor resultante del uso excesivo regular de medicamentos para la migraña por pacientes que tienen cefalea al menos 15 días por mes.3,56 La discontinuación del uso excesivo de medicación y el inicio del tratamiento preventivo son las conductas necesarias en tales casos.56
Ha habido un cauteloso entusiasmo por los antagonistas del receptor de PRGC de molécula pequeña, llamados gepantes, y los agonistas del receptor de 5-hidroxitriptamina tipo 1F (5-HT1F), llamados ditanes, en el tratamiento de la migraña aguda.51-54 La Administración de Alimentos y Drogas (FDA) ha aprobado los siguientes gepantes y ditanes orales para el tratamiento de la migraña aguda: ubrogepant, rimegepant y lasmiditán.
En la actualidad, los altos costos y la disponibilidad restrictiva de los gepantes y ditanes probablemente limita su uso a pacientes para los que los AINEs y los triptanos son ineficaces, tienen perfiles de efectos secundarios inaceptables, o están contraindicados. Lasmiditán se asocia con dificultades para el manejo y con una incapacidad para evaluar la propia competencia de conducción.57
En consecuencia, debido a que se aconseja a los pacientes que no conduzcan un vehículo de motor u operen maquinaria por al menos 8 horas después de la ingesta,57 el amplio uso de lasmiditán puede verse limitado. Las guías de consenso desaconsejan el uso de opioides y barbitúricos en el tratamiento de la migraña debido al riesgo de efectos adversos y dependencia.8,58
Tratamiento preventivo
La migraña es un trastorno recurrente, y el manejo a largo plazo puede requerir tratamiento preventivo. El objetivo es reducir la frecuencia, duración o gravedad de los ataques más que curar la migraña.8 Los médicos pueden transmitir dicha información a los pacientes para llegar a un acuerdo sobre objetivos de tratamiento realistas.
El asesoramiento sobre cuando el tratamiento preventivo debe ser iniciado en el curso de una trayectoria de migraña de un paciente individual varía entre países, pero dicho tratamiento se recomienda generalmente para pacientes que tienen al menos dos días de migraña por mes y cuyas vidas se ven afectadas negativamente a pesar de la terapia.8
Las clases de fármacos más utilizadas son los agentes antihipertensivos (por ejemplo, beta bloqueantes y candesartán), antidepresivos (por ejemplo, amitriptilina), anticonvulsivantes (por ejemplo, topiramato y valproato de sodio) y bloqueantes de canales de calcio (flunarizina).45 Para la migraña crónica, se ha documentado la eficacia basada en evidencia del topiramato y onabotulinumtoxina A (Botox).60,61
Se han introducido recientemente nuevos tratamientos preventivos basados en mecanismos. Estos incluyen cuatro anticuerpos monoclonales inyectables dirigidos contra el PRGC o su receptor (eptinezumab, erenumab, fremanezumab, y galcanezumab), que han demostrado efectividad en ensayos aleatorios para el tratamiento preventivo de la migraña episódica y crónica.62-71
Estos medicamentos tienen un rápido inicio de efecto y dan lugar a pocos eventos adversos, siendo los más comunes las reacciones en el sitio de inyección y el dolor.62 Erenumab, fremanezumab y galcanezumab también ha demostrado ser beneficiosos en pacientes que no responden a otras clases de medicamentos preventivos.62
En un estudio de extensión de etiqueta abierta de 5 años, erenumab continuó siendo seguro en pacientes con migraña episódica,63 aunque se necesitan más datos para confirmar estos hallazgos y evaluar la seguridad a largo plazo de todos los agentes de esta clase. Los agentes no han sido comparados con los medicamentos preventivos orales de uso común enumerados anteriormente, que son menos costosos y más accesibles.
La experiencia clínica sugiere que se puede evaluar la respuesta al tratamiento y se puede considerar la sustitución por otro medicamento después de aproximadamente 2 a 3 meses para los medicamentos preventivos orales, después de 3 a 6 meses para los anticuerpos monoclonales dirigidos a CGRP o su receptor, y después de 6 a 9 meses para onabotulinumtoxina A.
Algoritmo de tratamiento y directrices
Un algoritmo de tratamiento propuesto para el manejo clínico de la migraña que puede apoyar la toma de decisiones se muestra en la Figura 1. Organizaciones profesionales han publicado guías para el manejo clínico de la migraña, incluyendo la Sociedad Americana de Cefaleas y la Federación Europea de Cefaleas.36,54,57
Migraña en niños y adolescentes
Las estrategias de manejo clínico para la migraña en niños y adolescentes difieren algo de las estrategias de manejo en adultos y pueden requerir la participación de miembros de la familia.
Cuando un médico determina que es necesaria medicación para la migraña en un niño, el ibuprofeno se considera el fármaco inicial de elección.74,75 Si el ibuprofeno es ineficaz, puede probarse con triptanos orales y con la combinación de sumatriptán y naproxeno sódico.74,75
Hay menos evidencia que respalde el uso de medicamentos preventivos, como topiramato, amitriptilina y propanolol en niños y adolescentes. En un ensayo controlado con placebo, el topiramato y la amitriptilina no fueron superiores al placebo para la prevención de la migraña en pacientes de 8 a 17 años de edad.76
Los niños y adolescentes pueden beneficiarse con las terapias bioconductuales, como la biorretroalimentación, la relajación y la terapia cognitiva conductual.74 Se ha publicado una revisión de las estrategias de tratamiento para niños y adolescentes.74
Conclusiones
La comprensión de los mecanismos subyacentes a la migraña ha evolucionado durante la última década, con nuevos conocimientos sobre su patogenia y el desarrollo de terapias basadas en mecanismos, pero continúa las dudas sobre estos mecanismos y ciertos medicamentos.
Estas incertidumbres incluyen el origen exacto del dolor de migraña, el mecanismo subyacente a la naturaleza paroxística y las características de la migraña, y el sitio exacto y modo de acción de los medicamentos específicos para la misma. Se necesita un esfuerzo para encontrar nuevos objetivos farmacológicos y desarrollar biomarcadores que puedan predecir qué pacientes tendrán una respuesta a cada terapia dirigida.
Tabla 1. Criterios diagnósticos para la migraña sin aura, la migraña con aura y la migraña crónica*
|
Tipo de migraña |
Criterios diagnósticos |
|
Migraña sin aura |
Al menos cinco ataques que cumplen los siguientes cuatro criterios: Cefalea que dura de 4 a 72 horas (cuando no se trata o no se trata con éxito) Cefalea con al menos dos de las siguientes cuatro características: Ubicación unilateral Calidad pulsante Intensidad de dolor moderada o severa Agravación al realizar o evitar la actividad física de rutina (por ejemplo, caminar o subir escaleras) Cefalea acompañada de al menos uno de los siguientes síntomas: Náuseas, vómitos o ambos Fotofobia y fonofobia No se explica mejor por otro diagnóstico de ICHD-3 |
|
Migraña con aura |
Al menos dos ataques que cumplen los siguientes tres criterios: Una o más de los siguientes síntomas de aura completamente reversibles: Visual Sensorial Habla, lenguaje o ambos Motor Tronco encefálico De retina Al menos tres de las siguientes seis características: Al menos un síntoma de aura se extiende gradualmente por un período ≥ 5 minutos Dos o más síntomas de aura que ocurren en sucesión Cada síntoma del aura dura entre 5 y 60 minutos Al menos un síntoma de aura unilateral Al menos un síntoma de aura positivo Cefalea que acompaña al aura o que sigue al aura dentro de los 60 minutos No se explica mejor por otro diagnóstico de ICHD-3 |
|
Migraña crónica |
Cefaleas (indicativas de migraña o cefalea tensional) en ≥ 15 días/ mes durante > 3 meses que cumplen los siguientes criterios: Ocurriendo en un paciente que ha tenido al menos cinco ataques que cumplen los criterios de migraña sin aura o los criterios para migraña con aura o ambos En ≥ 8 días/mes durante > 3 meses, características de migraña sin aura o de migraña con aura o que el paciente cree que es migraña al inicio y que se alivia con un triptano o derivado del cornezuelo de centeno. No se explica mejor por otro diagnóstico de ICHD-3 |
*Criterios diagnósticos de la Clasificación Internacional de Trastornos de Cefalea, 3a edición (ICHD-3).3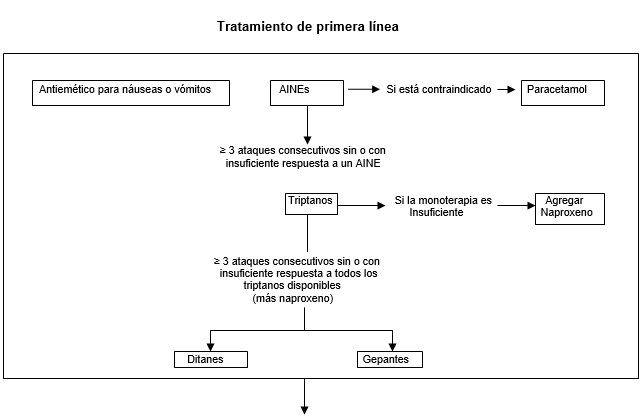
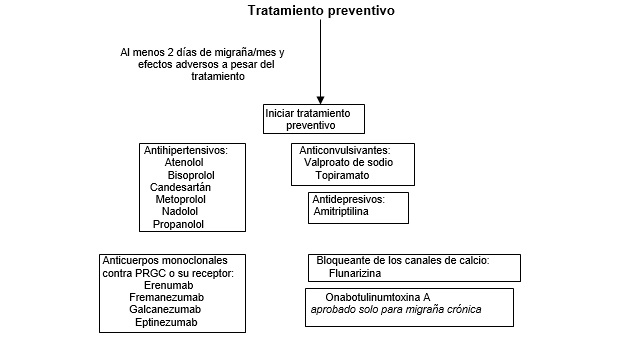
Figura 1. Algoritmo de tratamiento propuesto para el manejo clínico de la migraña.
Los antiinflamatorios no esteroides (AINEs) deben considerarse medicamentos de primera línea para el tratamiento de los ataques de migraña. Para los pacientes en quienes los AINEs no proporcionan un alivio del dolor o éste es insuficiente, se les debe ofrecer un triptano oral. Si un triptano oral no proporciona alivio del dolor, deben ofrecerse otros triptanos.
Se debe ofrecer una terapia combinada con naproxeno sódico a los pacientes que tienen un alivio inadecuado del dolor con un triptano. Idealmente, los médicos deberían ofrecer primero sumatriptán subcutáneo cuando un paciente no ha tenido un alivio adecuado del dolor con todos los triptanos orales.
Sin embargo, el sumatriptán subcutáneo se puede probar en una etapa más temprana si los triptanos orales no se pueden ingerir debido a los vómitos o si la intensidad de la cefalea alcanza su punto máximo rápidamente. Se pueden considerar ditanes y gepantes para pacientes en los que los AINEs y todos los triptanos disponibles son ineficaces, tienen perfiles de efectos secundarios inaceptables o están contraindicados.
La decisión sobre cuándo sustituir un triptán por un gepant o ditán puede diferir entre países y debe realizarse de acuerdo con las guías de práctica local. Se pueden ofrecer agentes antieméticos como terapia complementaria en pacientes con ataques acompañados de náuseas o vómitos. El inicio del tratamiento preventivo depende de las guías de práctica local, pero en general, debe considerarse para pacientes que tienen al menos 2 días de migraña por mes y se ven afectados negativamente a pesar del tratamiento.
Comentario
La migraña es un trastorno neurológico frecuente que afecta a millones de personas en todo el mundo, predominantemente mujeres, y es una causa importante de discapacidad.
Aunque su patogenia no se comprende completamente, se ha avanzado en la identificación de moléculas de señalización que están involucradas en la génesis del ataque de migraña, lo que ha facilitado el desarrollo de terapias basadas en mecanismos.
Si bien esta revisión describe la comprensión actual sobre la génesis y las características de la migraña y las prácticas recomendadas para el tratamiento agudo y preventivo de la misma, se requieren nuevas investigaciones para dilucidar completamente los mecanismos subyacentes y ayudar así a desarrollar terapias dirigidas cada vez más efectivas.
Fuente: IntraMed
Acceda a la bibliografía haciendo click aquí.

